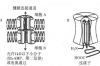
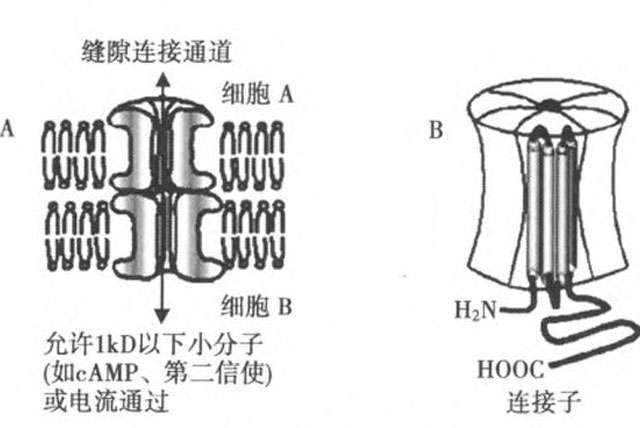
 图1 缝隙连接机构图
心房颤动(房颤)是最常见的一类室上性心律失常。它既见于有基础心脏病变的患者,也见于无任何临床病变的患者。随着老龄化社会的到来,房颤的发病率、致残率及病死率不断攀升,已成为令人关注的公众健康问题 房颤的发病机制,是一个复杂的病理生理过程,迄今尚未完全明了。目前认为心律失常的出现依赖致心律失常的基础因素、触发因素以及维持因素。对房颤而言,其基础因素是心房肌细胞不应期缩短、离散度增加以及电传导减慢;其触发因素是胸部大静脉的异常激动;而房颤的维持因素则恰恰是房颤本身。亦即持续性房颤诱发心房电和结构重构,而心房重构又是维系房颤持续存在的关键因素,两者互为因果,循序推进。 心房结构重构表现为亚细胞结构上的线粒体体积变化和内质网的裂解,细胞结构上的心肌肥厚,组织结构上的纤维紊乱和胶原沉积增加;心房电重构则包括离子通道和缝隙连接蛋白表达的改变。心房肌细胞动作电位传导性依赖于有效动作电位的产生(钠离子通道的兴奋性)和低阻抗电流途径(缝隙连接),当细胞失偶联(缝隙连接断裂)和兴奋性受损(钠离子通道的可激动性下降)时,异常的电传导将会加速和/或维系房颤的发生。一直以来,电生理工作者不断地尝试干预异常的电传导,以期达到治疗房颤的目的。但现有的针对心肌细胞膜上离子通道或受体的抗心律失常药物,虽然可以取得良好的短期疗效,却由于这些药物本身都有致心律失常作用,尤其是在心肌缺血时,而使其应用受到了极大的限制。因此,探寻新的房颤治疗靶点及开发新型的房颤治疗药物已经迫在眉睫。 缝隙连接是心肌细胞闰盘的3种连接结构之一。它与桥粒(desmosomal)和粘连膜(fascia adherens)-起,将单个的心肌细胞连接成一个功能整体,以确保心脏同步收缩。在每个心肌细胞两纵轴端细胞膜处,6个跨膜结构——连接蛋白(connexin,Cx)紧密围绕,形成直径约2nm的中空亲水孔道——连接子(connexon);相邻两个心肌细胞的连接子互相接近,形成间距约4 nm的连接结构,即为缝隙连接(图1)‘副。迄今为止,人体中已发现21种连接蛋白亚型。其中Cx43分布于心室工作细胞为主的各腔室心肌细胞中,Cx40主要表达在心房工作细胞、心脏特殊传导系统和脉管系统,而Cx45主要见于心脏特殊传导系统,但在心房和心室工作细胞上也有少帚表达。 缝隙连接是保证心肌细胞动作电位传导的主要结构。缝隙连接允许半径<0.8~1.0nm的离子以及分子量<1000 D的分子通过,构成了心肌细胞间的电偶联和代谢偶联。缝隙连接大量分布在心肌细胞两纵轴端的闰盘内,而在细胞侧面分布稀疏,这一特点造就了心肌组织动作电位的不均一性传导。缝隙连接的功能状态受多种因素的影响:急性期主要通过连接蛋白的磷酸化和去磷酸化进行调解;慢性期则主要通过连接蛋白的表达和降解影响其数量和分布。 缝隙连接作为一种治疗房颤的重要靶点,早在1995年由Spach和Starmer提出。如今,随着我们对缝隙连接的生理学及分子生物学等特点的深入研究,其在房颤发病及治疗中的地位有了不断的提升。 首先,心房肌细胞突入肺静脉和上腔静脉形成的肌袖是触发房颤的结构基础。动物实验结果显示,在肺静脉和上腔静脉的肌袖内存在具有自律性的细胞,通过延迟后除极自动触发动作电位,与窦房结细胞类似,这些细胞的缝隙连接比较小,而这些细胞的连接蛋白分布,又是以Cx40围绕Cx43形成的环形分布,这些特点有助于激动从自律性细胞向周围扩布。同时,研究还在犬肺静脉肌袖的近端发现了传导延迟带,此处传导速度显著慢于左心房,是微折返形成的主要区域。此外,通过快速起搏和/或二尖瓣反流方式诱导动物房颤模型,可以监测肺静脉肌袖近端Cx43的表达量与左心房相似,而Cx40表达量则显著下降;但在上腔静脉肌袖处,Cx43表达上调而Cx40表达下调,且连接蛋白逐渐转向细胞侧方表达。这些结构特点最终诱发肌袖内电传导的延迟和不同步化而形成微折返。 其次,在人类心房中,Cx40和Cx43均有表达,它们或单独或相互,组装形成同型或异型的连接子,并通过其蛋白含量、分布位置及磷酸化状态决定重构后细胞间联系的强度,从而影响心肌细胞间的电传导速度和复极时的同步性。有研究认为:Cx43表达量不影响P波时限,故不是心房电传导的主要决定因素;相反,Cx40却可以延长P波时限及PQ/PR间期。但也有研究发现,电传导速度实际上与Cx40和Cx43的表达相对比例有关,而且只有在Cx43正常表达时Cx40表达才得以保证,故认为Cx43缺失是电传导异常的主要决定因素。而新近研究结果显示,房颤与Cx40/43表达的绝对值或相对值均无相关性,但与Cx40/43的非均匀再分布密切相关,并推测其再分布所致的电传导缺失和不均一性引起的折返形成是其机制所在。通常,Cx40/43在人类心房的两端和侧方分布就存在一定程度的不均一性,故侧方表达的连接蛋白的功能实际上尚不完全清楚。即使采用最新的转基因动物模型,其研究结果仍然是模棱两可,即敲除Cx40基因后,快速性房性心律失常发生率有显著增加的,也有无改变的。但是,采用转基因方法使Cx40/43表达量从房颤时水平恢复至窦性心律水平,则心房传导显著改善并致持续性房颤终止。 迄今为止,仅有少数几个人工合成肽,包括APP10、rotigaptide(ZP123)及GAP-134,作用于连接蛋白,使部分关闭的缝隙连接从新开放。 APP10,是最有效地通过重建细胞间连接而恢复受损传导的合成肽。它优先作用于部分失偶联的细胞,而对正常细胞的缝隙连接无明显作用。荧光染色法显示APP10是通过增加Cx43表达及抑制Cx40表达来改善细胞间缝隙连接,并推测其机制可能与PKC活性有关。而在房颤中,APP10的作用要复杂的多,可能与房颤的类型不同有关:如果是纤维化所致的细胞失偶联,则APP10无作用,如果是功能性细胞失偶联,则APP10的抗房颤作用才能显现。尤其是对缺血所致的失偶联,APP10有明确的改善作用。首先,APP10可以抑制缺血区内Cx43的去磷酸作用及抑制Cx43的重分布。其次,APP10可以改善缺血区内电传导的延缓及复极间期离散度的增加。因此,APP10对缺血区的优先作用,使得其相对于传统抗心律失常药物更具优势,后者通过作用于膜离子通道或多或少一致性减慢缺血区和非缺血区的传导,并由此导致或多或少的致心律失常作用。 ZP-123.是新近人工合成的六肽稳定复合物,主要选择性作用于Cx43。它可以预防动作电位离散度的增加,并在代谢应激状态下选择性预防心房电传导的减慢。因此,ZP-123可以显著降低房颤易感性,但值得注意的是,这种作用仅限于缺血和二尖瓣反流所致的房颤模型,而对心力衰竭合并的房颤模型无任何影响,这可能与心力衰竭模型中存在心房肌纤维化导致细胞间结构性失偶联有关,但具体机制仍需进一步研究证实。研究还发现,ZP-123预防缺血所致的心律失常可能与其改善Cx43的2个特殊位点的磷酸化作用有关,但其是否也作用于房颤时的心房连接蛋白,目前尚无依据。 GAP-134,依据APP10和ZP123药效基团的功能位点人工合成的小分子四肽物质,能够较好地改善心脏的传导速度。在感染性心包炎动物模型中,GAP-134可以改善心房传导,从而预防心房扑动/房颤的发生;而在起搏诱导房颤的模型中,GAP-134可以降低左心房内电传导的波长.而不影响左心房机械性重构。此外,CAP-134对开胸手术所致的缺血/再灌注性心律失常同样有效。但目前尚缺乏人体研究数据。 综上所述,虽然缝隙连接在房颤中的作用尚存诸多争议,但绝大多数研究支持Cx40和Cx43表达量减少、分布异常以及去磷酸化作用,是导致房颤发生的重要因素。而鉴于房颤发病机制的复杂性,采用转基因方法改变Cx40/43表达量来终止房颤的疗效仍存有争议。目前针对改善缝隙连接的合成肽主要是用于缺血所致的房颤,而这类房颤的治疗也恰恰是传统抗心律失常药物治疗的软肋,因此其运用前景十分乐观。但由于缺乏人体研究的数据,故而还有许多研究工作等待电生理工作者去完成。 |